Клетъчното деление – такова, каквото не сме го виждали никога досега
Изследователи замениха флуоресцентните молекули в стандартния процес на изобразяване с такива, които разсейват светлината, и разкриха едно изцяло ново ниво на (меко казано) ослепителни детайли в нашите живи клетки.
Иновативната промяна ще позволи на учените да наблюдават директно поведението на молекулите за много по-дълъг период от време, отваряйки прозорец към ключови биологични процеси като клетъчното делене.
"Живата клетка е натоварено място – навсякъде шават протеини", обяснява биомедицинският инженер от Мичиганския университет Гуанджи Куи. "Нашата суперразделителна способност е особено подходяща за наблюдение на тези динамични дейности."
Суперрезолюцията е процес за наблюдение на невероятно малки биологични структури. При него се използват поредица от снимки, направени от съзвездия от флуоресциращи молекули, които подчертават избрани области от целевата тъкан, като елиминират ефекта на замъгляване, предизвикан от поток от дифрактирана светлина.
Изследователите, които стоят зад разработването му, печелят Нобелова награда през 2014 г. Колкото и революционен да е процесът, способността на флуоресциращите молекули да поглъщат и след това да „изплюват“ обратно светлината с необходимата дължина на вълната се изчерпва в рамките на десетки секунди, което изключва картографирането на процеси с по-голяма продължителност.
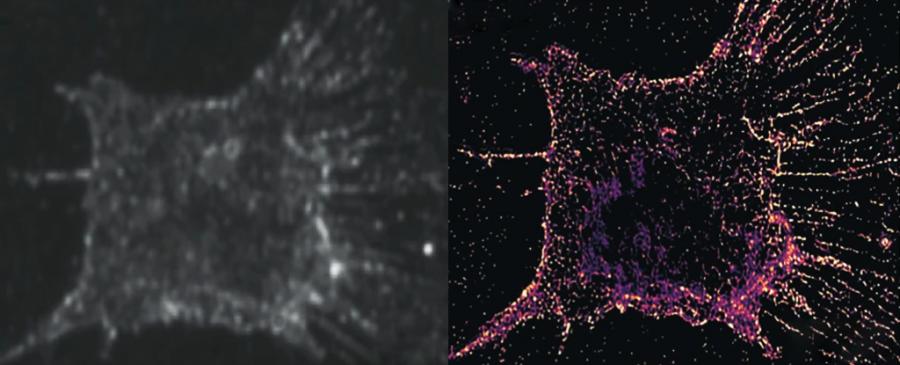
Затова Куи и колегите му разработват система за засичане на разсейването на светлината от произволно разпределени златни нанопръчици - процес, който не се разрушава при многократно излагане на светлина. Въпреки че златните маркери са по-големи от целевите структури, изобразяването на множество различно разположени подмножества от пръчки и комбинирането на изображенията осигурява същата високодетайлна разделителна способност.
Получената система позволява зашеметяващите 250 часа непрекъснати наблюдения при разделителна способност от само 100 атома.
След това Куи и колегите му изследват целия процес на клетъчно делене с новата си наноскопия PINE, разкривайки невиждано досега поведение на актиновите молекули - чак до нивото на отделната молекула.
Актинът, основният компонент на клетъчния цитоскелет, осигурява структурна опора на клетките и улеснява движението в тях. Така че тези разклоняващи се молекули с форма на нишки играят огромна роля при разделянето на клетката, преди да я разкъсат на две дъщерни клетки.
Всяко копие на тези клетки наследява едни и същи вътрешности - от белтъци до ДНК, но как точно се случва това, дълго време учените нямаха представа как точно се случва това поради ограниченията на нашата визуална технология.
Като наблюдават 904 актинови нишки по време на процеса на клетъчно делене, Куи и екипът му могат да видят как отделните молекули се държат помежду си. Те откриват, че когато молекулите на актина са по-малко свързани една с друга, те ще се разширяват в търсене на повече връзки. Когато всеки актин достигне до съседите си, той привлича други актинови молекули и увеличава допълнително мрежата си.
Изследователите виждат как тези движения в малък мащаб се пренасят в по-голям клетъчен план. За тяхна изненада когато актинът се разширява, клетката всъщност се свива и обратното. Това само по себе си е противоречиво поведение. Ето защо изследователите искат да проучат как се случва това противоположно движение.
"Планираме да използваме нашия метод, за да проучим как други молекулярни градивни елементи се организират в тъкани и органи", пише биомедицинският инженер от Мичиганския университет Сомин Лий за The Conversation.
"Нашата техника може потенциално да помогне на изследователите да визуализират и на свой ред да разберат по-добре как молекулярните дефекти в тъканите и органите могат да се развият в болест."
Изследването е публикувано в Nature Communications.
Източник: Science Alert