Някои мозъчни клетки устояват на деменцията – и учените вече знаят защо
Някои неврони успяват да се противопоставят на токсичните процеси, свързани с болестта на Алцхаймер и други форми на деменция. Сега учените са идентифицирали своеобразния „клетъчен екип за опасни отпадъци“, който поддържа тези клетки здрави.
Невродегенеративните заболявания, включително деменцията, се характеризират с натрупване на белтъци в мозъка, които увреждат и убиват невроните. Един от основните виновници са тау-протеините – но те не винаги играят негативна роля.
В нормалното си състояние тау-протеините стабилизират структурите в мозъка и подпомагат транспорта на хранителни вещества. Когато обаче се нагънат неправилно, те се слепват в агрегати, а колкото по-голямо е това слепване, толкова по-напреднал е невродегенеративният процес.
В ново изследване учени от UCLA Health и Калифорнийския университет в Сан Франциско използват CRISPR-базирано генетично скриниране, за да проучат натрупването на тау в лабораторно отгледани неврони, получени от човешки стволови клетки. Изследването има и една особено важна особеност.
„Това, което прави проучването особено ценно, е, че използвахме човешки неврони, носещи реална мутация, причиняваща заболяване“, казва Ави Самелсън, доцент по неврология и биологична химия в UCLA Health и първи автор на изследването. „Тези клетки естествено показват различия в обработката на тау-протеина, което ни дава увереност, че идентифицираните механизми са релевантни за човешката болест.“
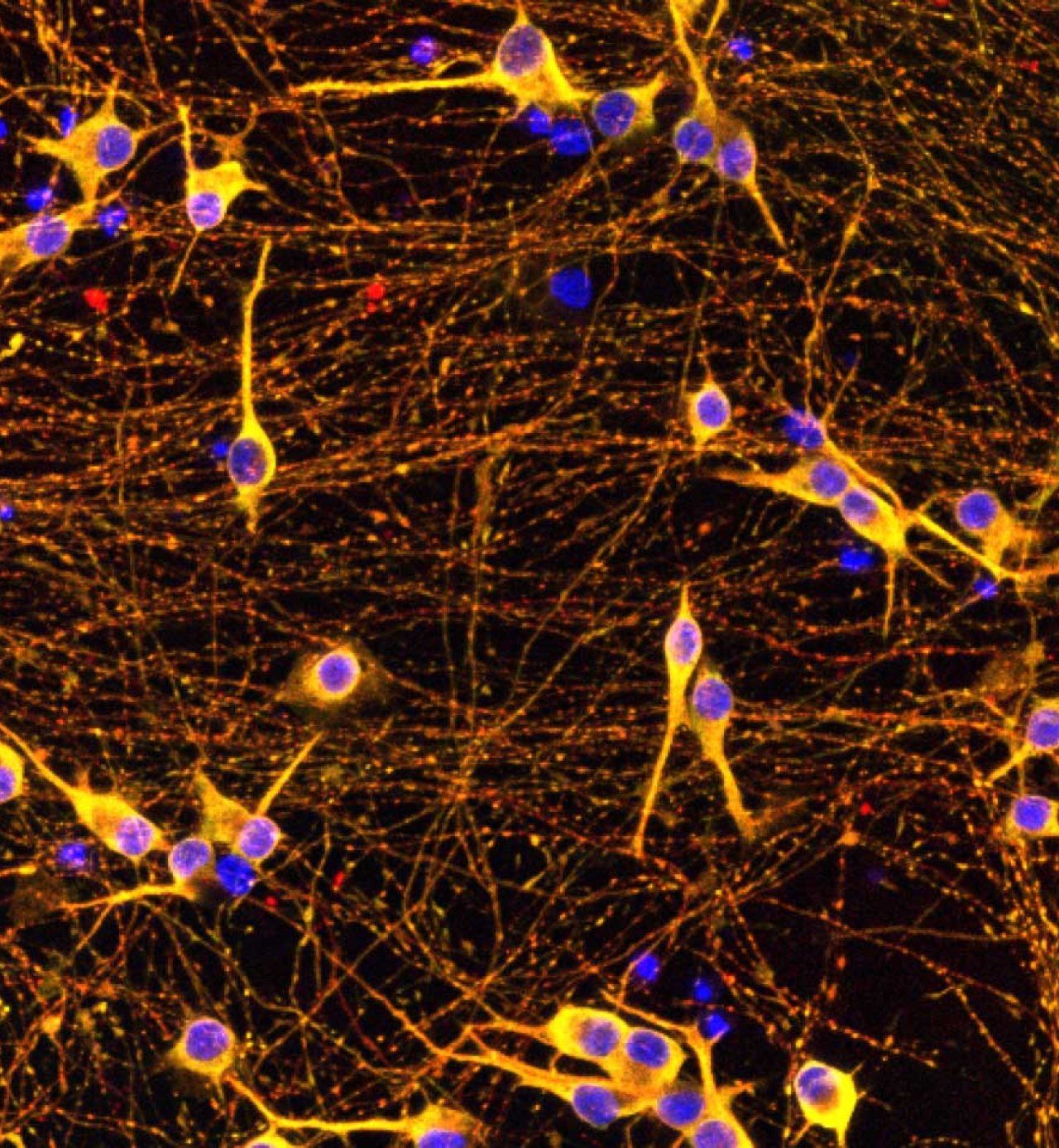
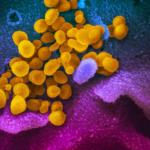
Нетипичното натрупване на тау-протеин (в жълто) в невроните (в червено и синьо) е свързано с болестта на Алцхаймер, фронтотемпоралната деменция и други форми на невродегенеративни заболявания. (Avi Samelson/ Kampmann Lab/UCSF)
Мутацията MAPT V337M води до засилено агрегиране на тау-протеини, които приемат вредна структура, известна като „Алцхаймеров сгъв“.
Досега учените са изследвали човешкия геном, за да открият фактори, които влияят върху риска от заболяване, но без да изяснят молекулярните механизми зад тях. Други изследвания са описвали различия между невроните, но без експериментална основа за доказване на причинно-следствена връзка.
„За първи път успяхме да скринираме човешки неврони за гени, които определят тяхната устойчивост към тау“, казва Мартин Кампман, професор по биохимия и биофизика в Калифорнийския университет в Сан Франциско и старши автор на изследването.
С помощта на CRISPR изследователите систематично анализирали „почти всеки ген в човешкия геном“. Те намалили или инактивирали около 20 000 отделни гена в лабораторните неврони, за да установят как всеки от тях влияе върху токсичното слепване на тау-протеина. Повече от 1 000 гена се оказали свързани с образуването на вредни агрегати.
Допълнителен анализ посочил ключов играч – протеинов комплекс, наречен CRL5SOCS4, който помага на мозъчните клетки да устоят на токсичното натрупване на тау. Той прикрепя молекулярен „етикет“ към тау-протеините, маркирайки ги за разграждане от протеазомите – своеобразните „сметосъбиращи инсталации“ на клетката.
За да проверят дали лабораторните резултати съответстват на реални случаи, учените използвали данни от Seattle Alzheimer's Disease Brain Atlas – база данни от мозъчни тъкани на починали пациенти с Алцхаймер. Оказало се, че клетките с по-висока експресия на CRL5SOCS4 показват по-голяма преживяемост.
Токсичните форми на тау могат да възникнат и при нарушена функция на митохондриите – „енергийните централи“ на клетката. Когато учените потиснали гени, свързани с митохондриалната функция, това довело до образуване на фрагменти от тау-протеина.
Тези фрагменти наподобяват важен биомаркер, откриван в кръвта и цереброспиналната течност на пациенти с Алцхаймер. Смята се, че клетките ги произвеждат в отговор на оксидативен стрес – процес, свързан с производството на енергия и засилващ се с възрастта и невродегенерацията.
Следователно нарушената митохондриална функция може да направи тау-протеина по-„лепкав“ и склонен към слепване.
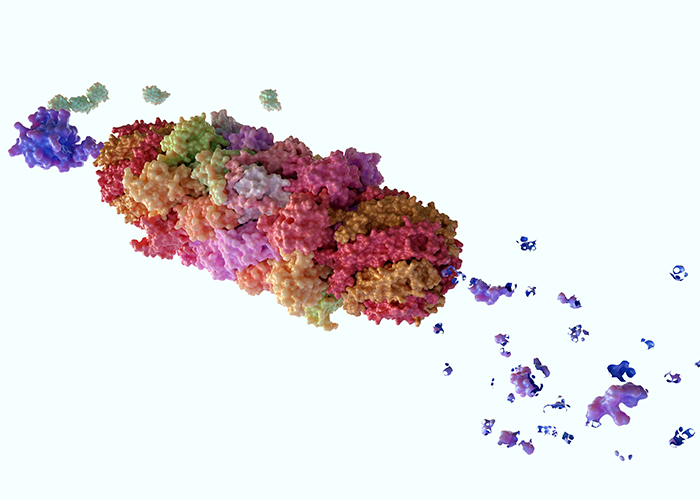
Илюстрация на протеазома, който „рециклира“ увреден белтък, маркиран за разграждане с молекулен маркер, известен като убиквитин. (KU Medical Center)
Проучването показва колко мощни са генетичните скринингови методи за разкриване на неизвестни механизми на заболяване. Учените откриват и нови пътища за контрол на нивата на тау-протеина, въпреки че засега не е напълно ясно как точно действат.
Следващата стъпка е тези открития да бъдат превърнати в практически терапии. Изследователите предлагат две възможности: първо, засилване на активността на CRL5SOCS4, за да се улесни отстраняването на тау-протеина, преди да се натрупа; и второ, защита на протеазомите от оксидативен стрес, тъй като увредените протеазоми не могат ефективно да разграждат тау.
„Може би бъдеща терапия ще засили естествения механизъм на организма за избягване на невродегенерация“, казва Кампман.
Изследването е публикувано в списание Cell.