За първи път учените напълно изтриват паметта на клетката и я превръщат в стволова
Учените отдавна могат да подканват човешките клетки да приемат нови форми – с помощта на специална комбинация от химикали те превръщат кожни клетки в пластични тъкани, известни като индуцирани плурипотентни стволови клетки.
Въпреки това въпросните клетки все още запазват няколко генетични спомени от времето, когато са били напълно развита тъкан, което пречи на използването им.
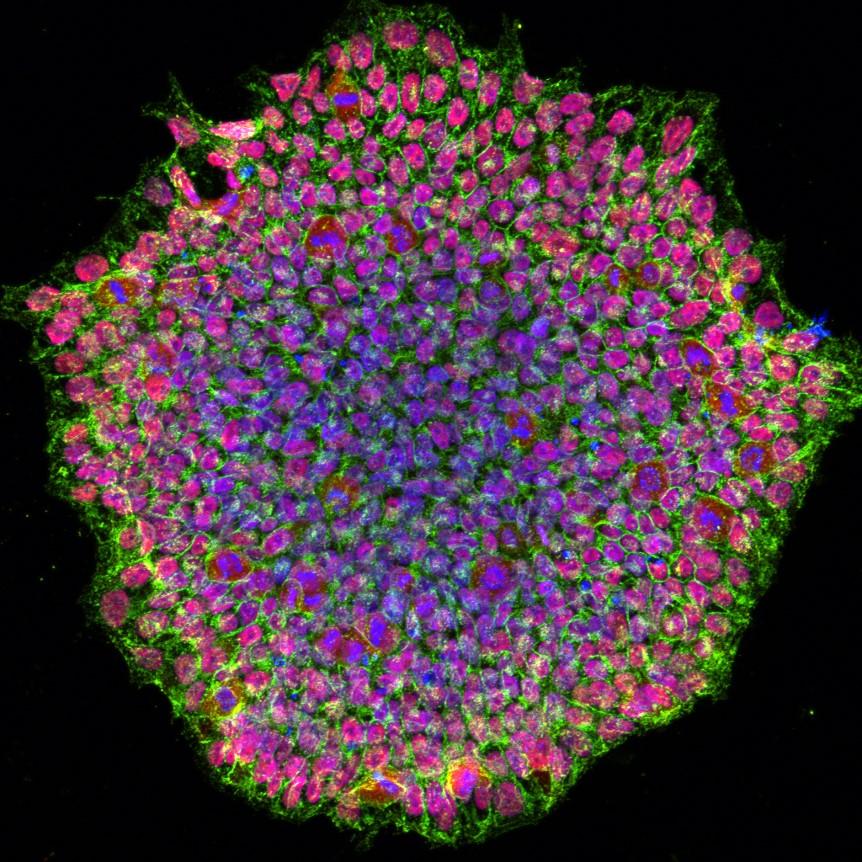
Сега международен екип от изследователи е постигнал още по-добри резултати: намерен е нов, по-ефективен начин за изтриване на паметта на клетките и препрограмирането им в стволови.
Всичко това може да звучи като молекулярно вълшебство, но индуцираните плурипотентни стволови клетки (iPSC), както са известни, се използват в медицинските изследвания за моделиране на заболявания и разработване на терапии от 2006 г. насам.
Това откритие, направено от двама японски учени, отвори вратите към нова сфера на регенеративната медицина, при която от обикновени човешки възрастни клетки могат да се създадат ембрионално-подобни стволови с помощта на набор от препрограмиращи фактори.
Потенциалът на iPSC е огромен. Тези клетки могат да се размножават неограничено и да дават началото на всеки друг тип клетки в организма. От една страна, iPSC са особено полезни инструменти за изучаване на болести. От друга, представляват първата стъпка към създаването на индивидуализирани клетъчни терапии, които биха могли да заменят увредени или болни тъкани.
В лабораторни условия учените използват iPSC за отглеждане на сърдечна тъкан, която бие като истински сърдечни клетки, и за създаване на миниатюрни копия на органи, наречени органоиди.
Освен това iPSC ни дадоха неповторим поглед върху основите на клетъчното делене и невродегенеративните заболявания като болестта на Алцхаймер и болестта на моторния неврон.
Но процесът на създаване на iPSCs не е съвършен: някои клетки запазват епигенетичните промени, нанесени върху тяхната ДНК в диференцирано състояние, или дори претърпяват спонтанни промени в тези епигенетични "спомени", които могат да повлияят на поведението на клетката.
"Това може да доведе до функционални разлики между iPS клетките и ембрионалните стволови клетки, които те трябва да имитират, и специализираните клетки, получени впоследствие от тях, което ограничава използването им", обяснява авторът на изследването Райън Листър, геномен биолог в Университета на Западна Австралия.
Затова Листър и колегите му се опитват да определят кога тези аномалии се появяват по време на клетъчното препрограмиране и да разберат как те и други оставащи белези могат да бъдат избегнати или заличени.
Екипът извършва профил на генната експресия, докато клетките преминават през процеса на препрограмиране, за да разбере кои гени се включват (и кога).
Голяма част от ДНК-то на клетката е навита около обемисти протеини, наречени хистони, които предпазват тези участъци от клетъчните процеси, чиято задача е да декодират гените в протеини.
В зависимост от това къде са разположени хистоните, клетката може да не реагира на химическите сигнали, с които учените ги захранват, като в този случай те носят епигенетична памет в процеса на препрограмиране.
Новият метод, наречен препрограмиране чрез преходно лечение (TNT), имитира нулирането на епигенома на клетката, което се случва в много ранното ембрионално развитие, преди и след като ембрионът се имплантира в стената на матката.
В поредица от експерименти с клетки изследователите показват, че препрограмирането с TNT "ефективно изтрива епигенетичната памет", особено в гъсто разположените области на ДНК, но без да изтрива друга важна информация, отпечатана в генома.
В резултат на това препрограмираните клетки наподобяват по-добре ембрионално-подобните стволови клетки по отношение на тяхната функция и на молекулярно ниво.
"Предвиждаме, че препрограмирането с TNT ще създаде нов критерий за клетъчните терапии и биомедицинските изследвания и ще ускори значително напредъка им", казва Листър.
"То решава проблемите, свързани с конвенционално генерираните iPS клетки, които, ако не бъдат преодолени, могат да имат сериозно вредни последици за клетъчните терапии в дългосрочен план", добавя Джиа Тан, автор на изследването и клетъчен биолог от университета Монаш в Мелбърн.
Изследването е публикувано в Nature.
Източник: Science Alert