Един често срещан ензим играе изненадваща роля в предотвратяването на рака
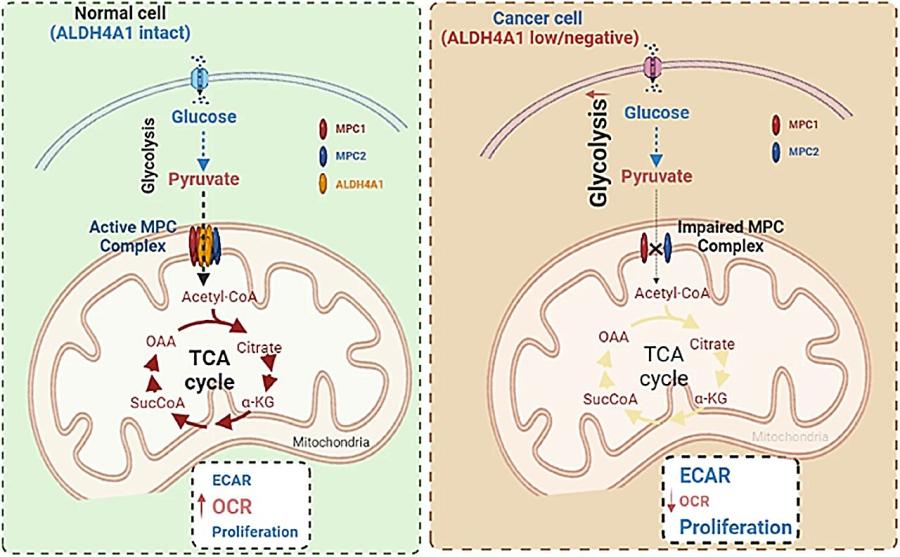
ALDH4A1 играе ключова роля в потискането на тумори, като поддържа митохондриалния комплекс за пренасяне на пируватна киселина.
Ензим, доскоро известен главно с ролята си в пролиновия метаболизъм, се оказва ключов фактор в борбата с туморната прогресия. Изследователи от Медицинския център на Университета Дюк и Университета Уейк Форест идентифицират ALDH4A1 като трети, структурно значим компонент на митохондриалния комплекс за пренасяне на пируватна киселина (MPC). Това откритие разкрива нов механизъм, чрез който клетките поддържат енергиен баланс и потискат туморогенезата.
Митохондриален контрол над клетъчния метаболизъм
Kомплексът MPC – съставен досега само от субединиците MPC1 и MPC2 – е отговорен за транспортиране на пируватна киселина от цитозола в митохондриите. Това е ключов процес за навлизане в цикъла на Кребс (TCA) и за нормалното клетъчно дишане. Натрупването на пируватна киселина в цитозола, често срещано при туморни клетки, води до метаболитно пренасочване към гликолиза – ефект, известен като метаболитният феномен на Варбург.
Добавянето на ALDH4A1 като трети компонент в този комплекс има значително въздействие: ензимът стабилизира структурата на MPC и подобрява транспорта на пируватна киселина, като ограничава риска от метаболитна дерегулация.
Доказателства от клетъчни и животински модели
В изследване, публикувано в Nature Cell Biology, учените използват различни молекулярни техники – от коимунопреципитация до масспектрометрия и имунофлуоресценция – за да докажат прякото взаимодействие между ALDH4A1 и MPC1/MPC2. Модели с ксенографтни тумори в мишки разкриват, че:
-
Свръхекспресията на ALDH4A1 потиска туморния растеж
-
Нокдаунът на ALDH4A1 ускорява образуването и разширяването на тумори
-
Инхибирането на MPC прекъсва взаимодействието ALDH4A1-MPC, но не и базовия MPC1/2 димер, което отваря врати за насочена медикаментозна намеса
ALDH4A1 – нова мишена за противоракови терапии
Резултатите показват, че ALDH4A1 играе роля не само като метаболитен ензим, но и като туморопотискащ фактор, поддържайки митохондриалната функция и предпазвайки клетката от метаболитно пренастройване. Това го прави обещаваща мишена за бъдещи терапии, които целят възстановяване на митохондриалния контрол върху енергийния метаболизъм в ракови клетки.
Изследването отваря нови възможности за разработване на лекарства, които да стабилизират ALDH4A1-MPC интерфейса или да модулират неговата активност, с потенциална клинична стойност при различни видове рак.
DOI: 10.1038/s41556-025-01651-8
Източник: Medical Xpress